细菌耐药性可分为天然耐药性和获得耐药性,各种细菌的耐药机制各有不同,但主要有产生灭活酶或钝化酶,药物作用靶位的变化,细胞壁通透性改变,主动外排机制等。只有了解这些机理才能更好地防止细菌产生耐药性。
一、细菌耐药性的产生及分类
1. 细菌耐药性的产生
细菌耐药性又称抗药性,是指细菌与抗菌药物多次接触后,对药物的敏感性下降或消失。耐药性一旦产生,药物的化学治疗作用就明显下降。
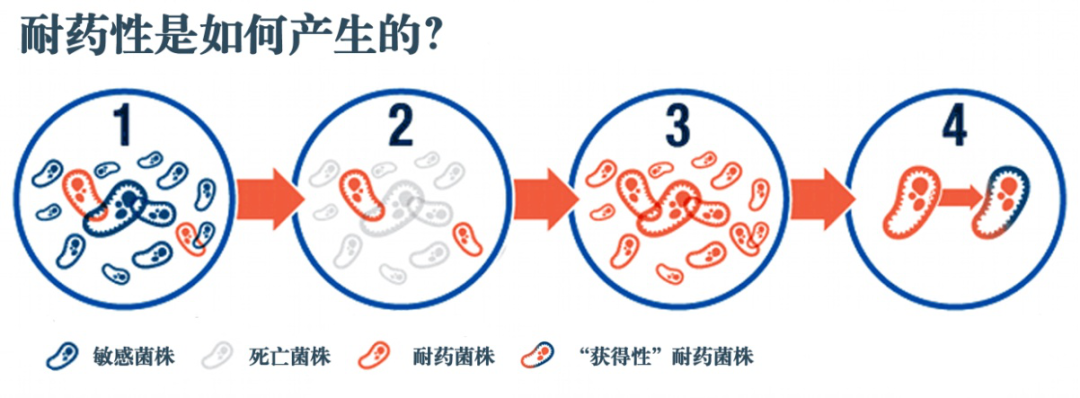
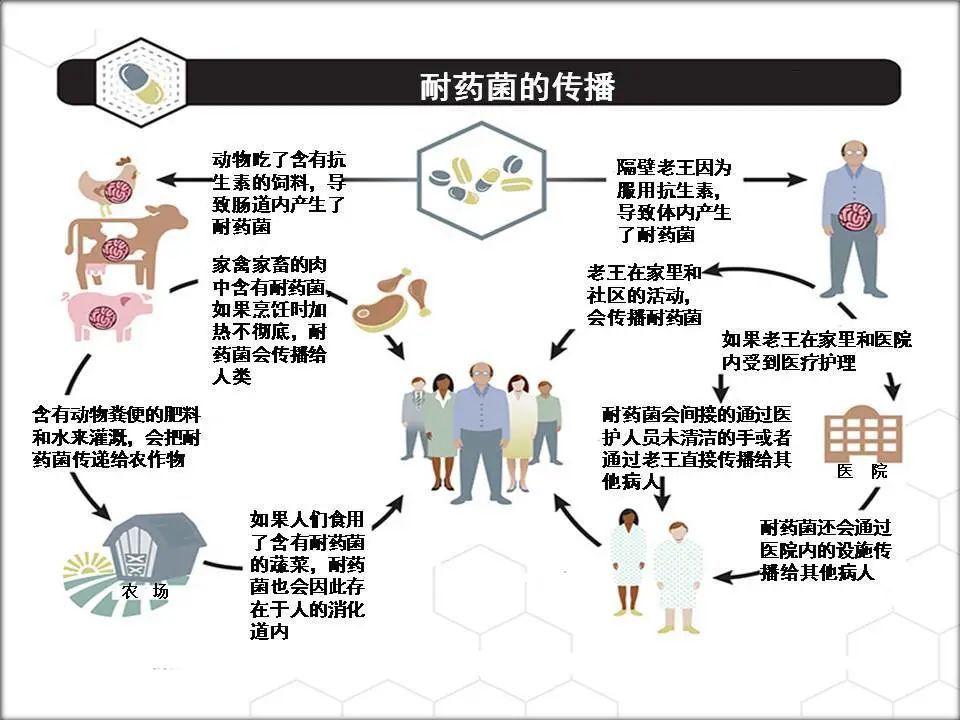
2. 细菌耐药性的种类
(1)天然耐药性
天然耐药性又称固有耐药性,是由染色体遗传基因介导的耐药性,它代代相传不会改变。如链球菌对氨基糖苷类抗生素天然耐药;肠道革兰氏阴性杆菌对青霉素天然耐药;铜绿假单胞菌对多数抗生素均不敏感。
(2)获得耐药性
获得耐药性是由于细菌与抗生素接触后,由质粒介导,通过改变自身的代谢途径,使其不被抗生素杀灭,而且质粒所带的耐药基因易于传播,耐药菌迅速生长繁殖。比如金黄色葡萄球菌产生 β-内酰胺酶类抗生素耐药。
细菌的获得性耐药可因不再接触抗生素而消失,也可由质粒将耐药基因转移至染色体而代代相传,成为天然耐药。
二、耐药性的产生机制
1. 细菌产生破坏抗生素结构的酶
细菌为了生存,可以产生一种或多种水解酶或钝化酶来水解或修饰进入细菌细胞内的抗生素,使之失去生物活性,这也是目前引起细菌耐药性的最重要机制。
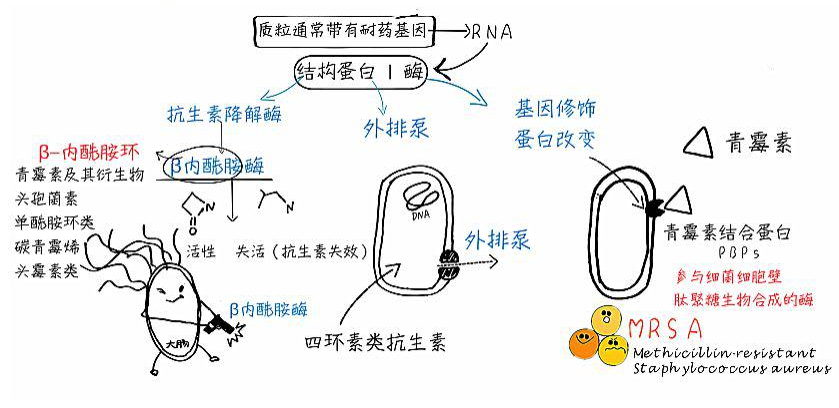
(1)β-内酰胺酶
它是细菌对 β-内酰胺类抗生素耐药的主要原因。由于 β-内酰胺酶的产生,使 β-内酰胺类抗生素的 β-内酰胺环的酰胺键发生断裂而失去抗菌活性。该类酶可以为染色体介导,也可为质粒介导 。
(2)氨基糖苷类钝化酶
临床上氨基糖苷类耐药的主要机制是钝化酶的产生,即抗生素的氨基或羟基被酶修饰后与核糖体结合不紧密而不能进入下一阶段发挥抗菌作用,使细菌在抗生素存在的情况下仍能存活在细菌胞浆内。
(3)氯霉素乙酰转移酶
氯霉素乙酰转移酶是由某些金黄色葡萄球菌、表皮葡萄球菌、D 组链球菌和革兰阴性杆菌产生的,是一种胞内酶,可以由染色体、质粒或转座子基因编码,使氯霉素转化为无抗菌活性的代谢物。
(4)红霉素酯化酶
由质粒介导的一种酶,主要作用是水解红霉素及大环内酯类抗生素结构中的内酯而使之失去抗菌活性[1]。
2. 药物作用靶位的变化
耐药菌药物作用点的结构或位置发生变化,使药物与细菌不能结合而丧失抗菌效能,或抗生素作用的靶位被细菌产生的某种酶修饰或发生突变而使抗菌药物无法发挥作用。
这种耐药机制在细菌耐药中普遍存在,作用靶位的细微变化都有可能产生很强的耐药性。常见的有青霉素结合蛋白(PBP)的改变导致的 β-内酰胺类抗菌药物耐药,MRSA 的产生及 DNA 拓扑异构酶的改变引起喹诺酮类抗菌药物耐药。
3. 渗透屏障通透性改变
由于细菌细胞壁的障碍或细胞膜通透性的改变,使抗生素无法进入细胞内与作用靶位结合发挥抗菌效能, 这是细菌的一种非特异性的防卫机制,主要见于革兰氏阴性菌。
因为革兰阴性菌的外膜同时是疏水性和亲水性物质的屏障。为了克服这种渗透性障碍,这些微生物进化出了毛细孔蛋白,在抗生素和其他小分子有机化学物质中充当非特异性的出入口点。当这些毛细孔蛋白数目明显减少时,细菌产生耐药性。
如铜绿假单胞菌对多种抗菌药物的耐药是因为其外膜存在着独特的外排系统,其次由于其外膜蛋白 OprF 缺失,使药物不易通过所致。
4. 药物主动外排系统
通过主动外排作用,将药物排出菌体外,药物的主动外排系统被认为是导致细菌对多种抗生素产生耐药性的重要原因。
目前主要有两大类外排系统:特异性外排系统和多种药物耐药性外排系统。特异性外排系统一般只作用于单一的底物(药物),常常是某一类的抗生素,如四环素、氯霉素等;而多种药物耐药性外排系统可以作用于多种抗生素或者一些结构和功能不相关的复合物。
5. 其他
如细菌通过增加抗菌药物的拮抗物、细菌代谢途径改变、营养缺陷以及外界环境变化等都可使细菌耐药性增强。
而且,需要注意的是,细菌耐药性复杂,临床上很多病原菌同时存在两种以上的耐药机制,使之对多种抗菌药物同时耐药。
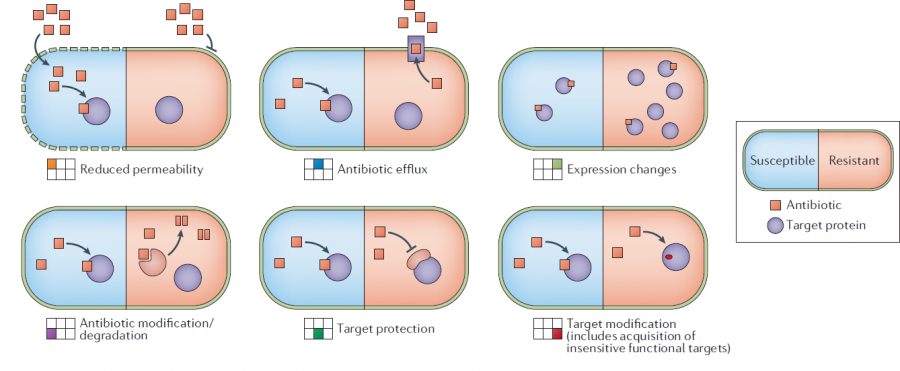
常见的耐药性产生机制[2]



主要抑菌抗生素的作用和常见耐药机制[3]
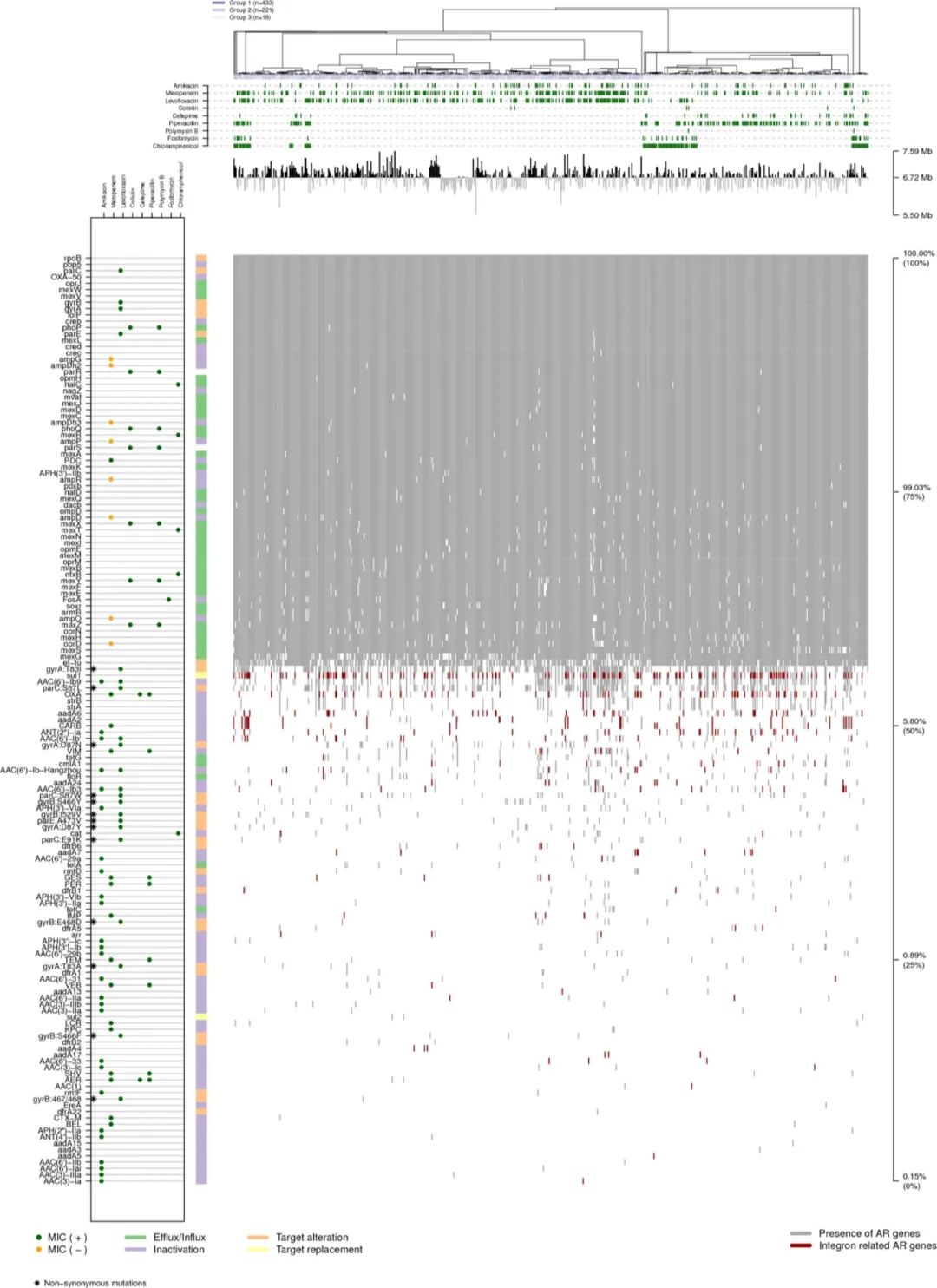
在一项对 672 株铜绿假单胞菌进行了基因组序列分析的研究发现[4],147 个致耐药因子涵盖了 5 种耐药机制,包括固有和获得性耐药。其中,与药物外排和孔蛋白相关的耐药性主要是固有的,而与抗生素失活相关的耐药性是获得性的。
美格医学助力临床精准诊断:
(1)宏基因组二代测序
mNGS 项目检测范围基于能提供广域搜索、并持续更新的参考基因组数据库,包含约有 60万+ 株微生物参考基因组,检测展示的结果主要来源于经过细致整理、可精确鉴定的微生物种类数据库,总共 23796 种。

图:mNGS 检测范围
(2)多重靶向测序 tNGS
tNGS 是 mNGS 技术的补充,解决了 mNGS 受人源基因组及背景菌基因组干扰的问题;解决了 mNGS 对结核、真菌、胞内菌等检出率低的问题;解决了 mNGS 检测技术对 RNA 病毒检测难度大的问题;解决了 mNGS 对耐药基因及毒力因子基因检测难点的问题。

图:tNGS 检测范围
参考文献:
[1] 任艳. 细菌耐药性产生机制及防控措施. 养禽与禽病防治, 2015(05): 2-3.
[2] Manish B, Alaric W. D'S, Gautam D, et al. Sequencing-based methods and resources to study antimicrobial resistance. Nat Rev Genet, 2019, 20(6): 356–370.
[3] Chowdhury M.H, Debprasad D, An N.T.N. Revisiting Antibiotic Resistance: Mechanistic Foundations to Evolutionary Outlook. Antibiotics, 2021, 1(40): 1-23.
[4] Magali J, Alex van B, Kyle C.C, et al. Correlation between phenotypic antibiotic susceptibility and the resistome in Pseudomonas aeruginosa. International Journal of Antimicrobial Agents, 2017, 50(2): 210-218.