传统的无菌标本的培养是病原诊断的“金标准”[1,2],但其诊断的敏感性远不能达到临床病原诊断的需求。宏基因组新一代测序技术(mNGS)相比较传统方法,具有快速,灵敏度高的优势,可以同时检测出一大群差异极大的微生物类群,尤其可以无差别的检测出已知或未知病原和耐药性基因信息[3,4],显著提升临床病原诊疗效能。有学者预测在未来10年内,宏基因组测序将作为常规检测手段应用于对病原体诊疗方面[5]。
在上篇中,我们已经详细介绍了“宏基因组学发展简史”和mNGS检测前注意事项,在本篇,我们将接着介绍mNGS检测后的注意事项。
mNGS检测后注意事项
一、mNGS检测影响因素[6]
1. 病原体基因组大小

2. 病原体生物结构

3. 样本人源占比

二、mNGS报告解读
1. 微生物菌种类型
明确的致病菌(低序列也需要临床考虑):
结核分枝杆菌复合群、鸟分枝杆菌、胞内分枝杆菌、脓肿分枝杆菌、军团菌、诺卡菌、流感病毒、新冠病毒、曲霉、新型隐球菌、马尔尼菲蓝状菌、组织胞浆菌、腺病毒、耶氏肺孢子菌、鹦鹉热衣原体、肺炎支原体、呼吸道合胞病毒等等。
条件致病菌(结合标本类型、序列数、微生物排名、动态变化及临床诊断综合判断):
铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌、肺炎链球菌、屎肠球菌、粪肠球菌、念珠菌、流感嗜血杆菌、嗜麦芽假单胞菌等等[6]。
常见的定植菌:
(1)呼吸道:丙酸杆菌属、棒状杆菌属、葡萄球菌属、莫拉菌属、韦荣球菌属、链球菌属、嗜血杆菌属、梭杆菌属、奈瑟菌属、普雷沃菌、假单胞菌属、卟啉单胞菌属等;
(2)皮肤:结核硬脂酸棒状杆菌、头状葡萄球菌、表皮葡萄球菌、模仿棒状杆菌、藤黄微球菌、痤疮丙酸杆菌、人葡萄球菌、非发酵棒状杆菌、缓症链球菌、球形马拉色菌、限制马拉色菌、合轴马拉色菌、塔宾曲霉等。
2. 阳性标准(仅供参考)
脑脊液样本:
(1)对于细菌、真菌与寄生虫,RPM(指每百万序列的特异性读长比率,RPM=RPM 脑脊液/RPM 非模板对照)≥10,判断为阳性;
(2)对于病毒(DNA或RNA病毒),检出读长应至少覆盖全基因组的 3 个非重叠区域,判断为阳性[7]。
呼吸道样本:
(1)细菌(分枝杆菌除外)、真菌、病毒:病原种类的相对丰度>30%,或某一病原培养阳性且mNGS序列数>50;
(2)结核分枝杆菌:只要有一条序列即可判断阳性;
(3)有临床其他试验(病理、培养、涂片、抗原或抗体检测、PCR)证明某 一微生物阳性时,mNGS鉴定的该微生物被归类为确认病原体;
(4)如果仅有mNGS检测出的传染性病原体,而没有其他任何临床试验验证,则此微生物被认为是潜在的病原体。所有经mNGS鉴定检出但不符合mNGS 阳性结果标准的微生物都被认为是不确定病原体[8-10]。
血液样本:
(1)明确感染(definite):mNGS检测的病原结果与其他微生物检测方法结果一致(同一样本检测期限为7天);
(2)临床诊断(probable):根据临床、放射学或实验室检查结果,测序病原体结果被认为是脓毒症预警的可能原因;
(3)拟诊(possible):病原结果具有与临床表现一致的潜在致病性,但对症状的另一种解释更有可能;
(4)不大可能(unlikly):结果与临床表现不一致[11]。
共识(阈值):
(1)一般细菌:mNGS检测到某种细菌(种水平)的序列数是其余所有细菌的10倍以上,有临床意义;
(2)真菌:mNGS检测到真菌(种水平)的序列数是其余所有真菌的5倍以上,有临床意义;
(3)MTB:为明确致病菌,环境污染的可能小。此外,因MTB为胞内致病菌,细胞外游离DNA 少,且MTB核酸提取效率低,mNGS只要检测到1条属水平的MTB复合群序列,且能排除其他标本携带污染,就有临床意义;
(4)非结核分枝杆菌:可能是环境中污染菌,若检出, 需结合背景微生物库和mNGS原始细菌列表进行结果判读。若排除污染后属水平或种水平序列数排名前十,则有临床意义[12]。
3. 报告解读常见错误
(1)Reads数最大,不一定是致病病原体:
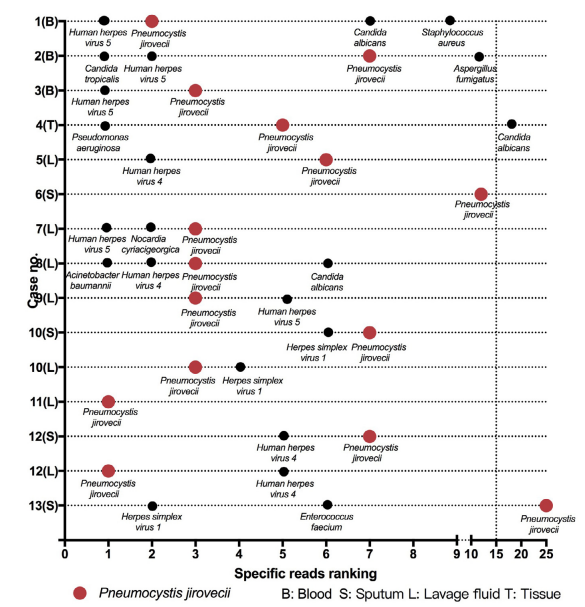
一项在13例耶氏肺孢子(PJP)感染病例中,mNGS检出的病原体reads数排名显示,PJP不都是排名第一,但是确是致病病原体。所以,mNGS检出病原体reads数的大小不一定决定致病的情况[7]。
(2)“被扔掉的数据”,不一定没有用(病例源自微信公众号“呼吸界”):



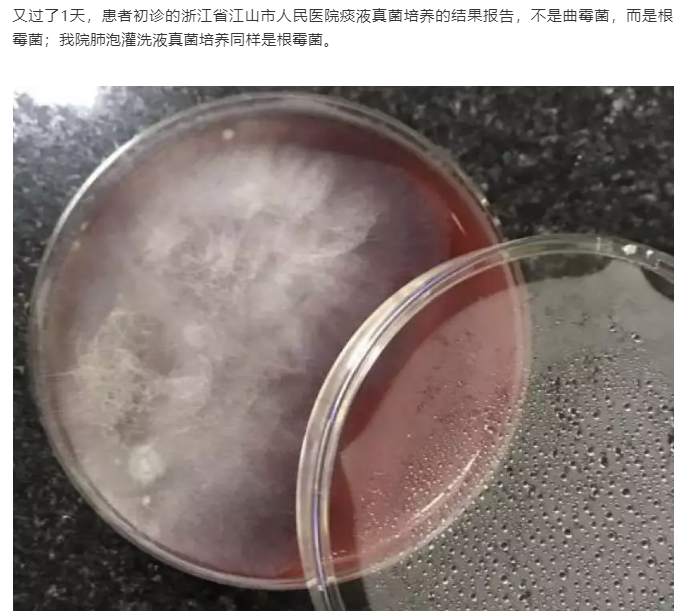
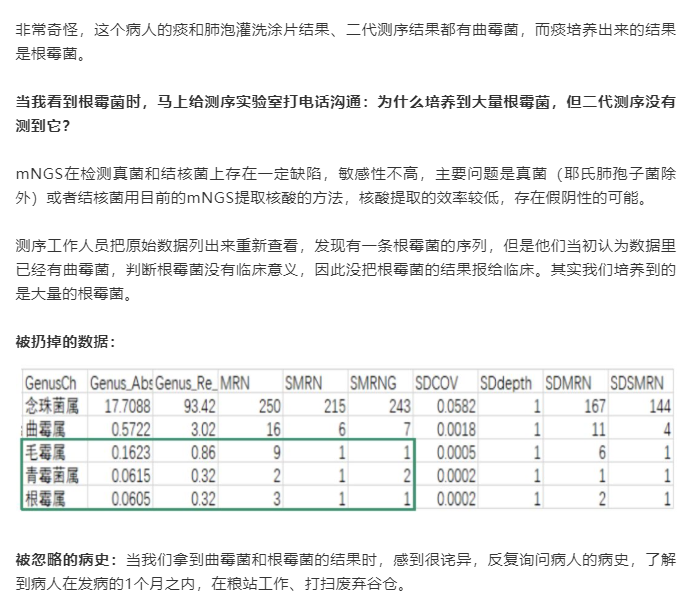
因此,在报告解读时,需要注意检出的疑似微生物列表,因为这也可能就是导致病人致病的主要原因。
(3)“不常见”的菌,不一定没有意义(病例源自微信公众号“呼吸界”):

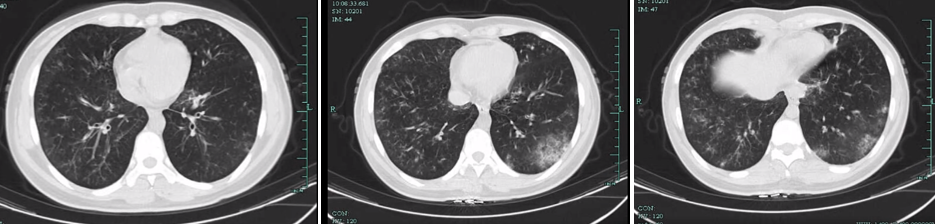
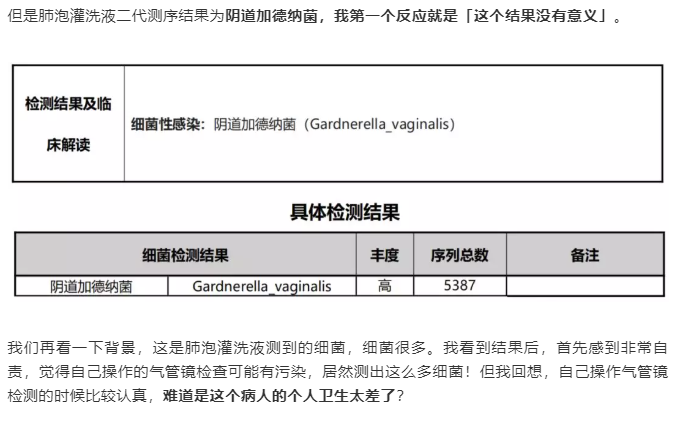
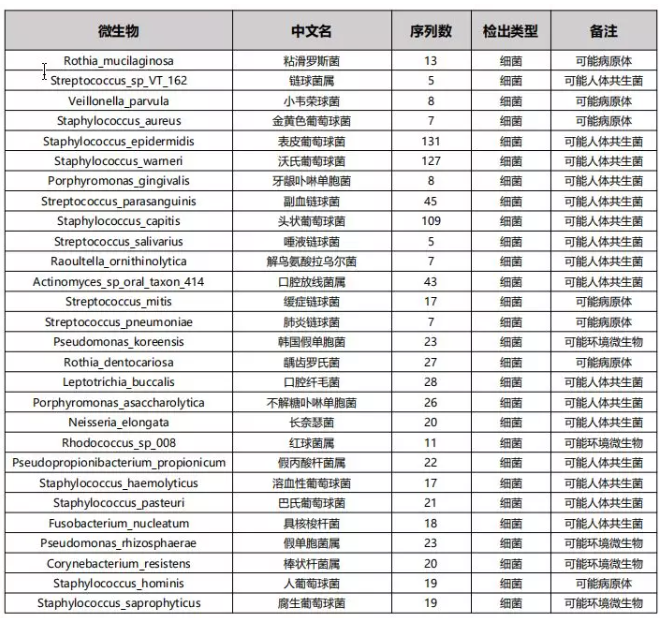

结论:这个病人为女性同性恋,所以,我们在遇到部位 “不常见” 病原检出时,一定要大胆实践,小心求证。
总结:
(1)mNGS已经越来越多的被临床所熟知,我们临床医生需要对其做好一定的了解,才能更好的利用好这个工具,更好的帮助临床;
(2)mNGS检测前(样本类型及采集等)和检测后(报告解读)是我们临床医生可控部分,尽可能的去遵循“专家共识”,让mNGS检测更有意义;
(3)目前mNGS尚无公认的阳性阈值标准,在一定情况下,我们可以用已发表的文献数据作一定的参考;
(4)感染性疾病病原诊断要以患者为中心,临床起主导作用,最终还是要回到患者本身。所以,面对mNGS技术,我们临床要大胆的实践,小心的求证。
[1]宁永忠. 细菌性感染性疾病的诊断分级. 中华传染病杂志, 2015, 33(1): 49-52.
[2]Donnelly JP, Chen S, Kauffman C, et al. Revision and Update of the Consensus Definitions of Invasive Fungal Disease From the European Organization for Research and Treatment of Cancer and the Mycoses Study Group Education and Research Consortium. Clinical Infectious Diseases, 2020, 71(6):1367-1376.
[3]Carpenter ML, Tan SK, Watson T, et al. Metagenomic Next-Generation Sequencing for Identification and Quantitation of Transplant-Related DNA Viruses. Journal of clinical microbiology, 2019, 57(12): e01113-19.
[4]Couto N, Schuele L, Raangs EC, et al. Critical steps in clinical shotgun metagenomics for the concomitant detection and typing of microbial pathogens. Scientific reports, 2018, 8(1):13767.
[5]Forbes JD, Knox NC, Ronholm J, et al. Metagenomics: The Next CultureIndependent Game Changer. Frontiers in microbiology, 2017, 8:1069.
[6]戴媛媛;马筱玲. 宏基因组二代测序技术在临床病原学诊断中的应用. 临床检验杂志, 2021.39(1):3.
[7]Miller Steve; Naccache Samia N; Samayoa Erik, et al. Laboratory validation of a clinical metagenomic sequencing assay for pathogen detection in cerebrospinal fluid. Genome research, 2019.29(5):831-842.
[8]Chen YQ, Feng W, Ye K, et al. Application of Metagenomic Next-Generation Sequencing in the Diagnosis of Pulmonary Infectious Pathogens From Bronchoalveolar Lavage Samples. Front Cell Infect Microbiol, 2021, 11:541092. 24.
[9]Li H, Gao H, Meng H, et al. Detection of pulmonary infectious pathogens from lung biopsy tissues by metagenomic next-generation sequencing. Front Cell Infect Microbiol, 2018, 8:205. 25.
[10]Langelier C, Zinter MS, Kalantar K, et al. Metagenomic sequencing detects respiratory pathogens in hematopoietic cellular transplant patients. Am J Respir Crit Care Med, 2018, 197:524–528.
[11]Blauwkamp TA, Thair S, Rosen MJ, et al. Analytical and clinical validation of a microbial cell-free DNA sequencing test for infectious disease. Nat Microbiol, 2019, 4(4): 663-674.
[12]Yi Zhang; Jing-Wen Ai; Peng Cui; et al. A cluster of cases of pneumocystis pneumonia identi