由病原微生物感染引起的感染性疾病是人类死亡率和发病率最高的疾病之一。病原感染类型种类繁多,包括细菌、真菌、病毒、寄生虫等,不同病原感染通常需要特定的治疗措施。因此,快速准确地检测出致病病原体是感染性疾病治疗与管理的关键。
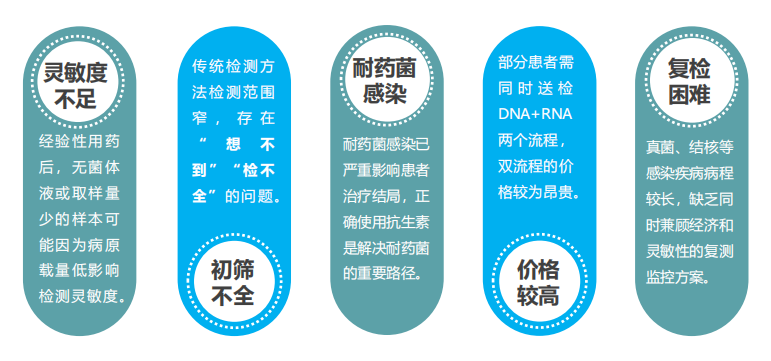
而现在,临床感染诊断面临着多方面的威胁与挑战,主要包括病原感染的多样性、患者临床症状不典型、病原体抗药性、诊断工具灵敏度不足、价格较高、复检困难等问题。
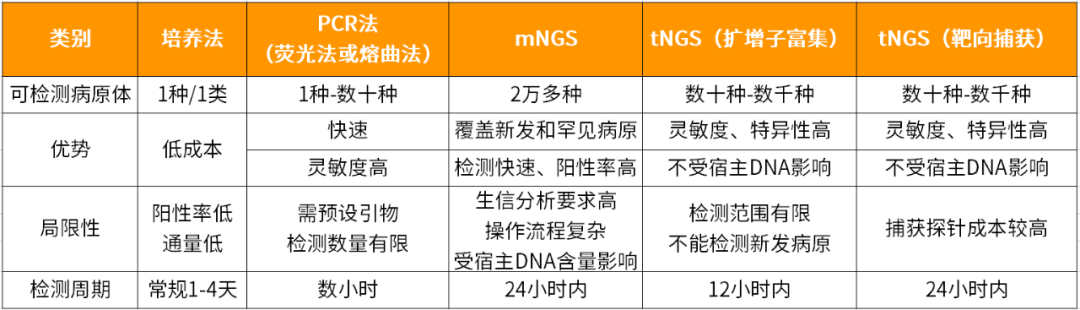
目前,用于临床病原体检测的方法主要有培养、生化、PCR、宏基因组二代测序(mNGS)、病原靶向测序(tNGS)等。不同检测方法各有优缺点,不能单说某种技术优劣,而是要将其放在一定的条件下去评价。
近几年,新冠的核酸检测让荧光 PCR 大放异彩,mNGS 也被众多临床医生青睐,具有无需预设、无需培养、高通量、可检测新发/罕见病原等优点。tNGS 更是异军突起,以其对“PCR”和“NGS”兼容并蓄的优势和快速、精准、高性价比的测序服务,现广泛应用于临床。下面,我们来具体了解下这项技术→
病原靶向测序
根据中国食品药品检定研究院对 tNGS 的描述,病原靶向测序(tNGS)通过超多重 PCR 扩增与高通量测序两种技术的结合,能够对待测样本中几十种至几百种已知病原微生物及其毒力和/或耐药基因进行检测。
对低浓度的病原微生物的检测,特别是其毒力和/或耐药基因检测,与病原宏基因组测序(mNGS)相比,tNGS 具有病原谱范围明确、测序成本低等优势。因此,tNGS 在临床检验领域正受到越来越多的关注。
这个评价算是非常高了,但 tNGS 的优点也确实值得被称赞,其中关键原因是测序价格的下降,从原来的三四千到现在的几百到一两千,使得其临床应用更加广泛了。
同时,就目前的数据来看,临床常见感染病原统共也就一两百种,与两万多种大海捞针式的宏基因相比,tNGS 性价比更高。
确实,与 mNGS 的广覆盖、无偏倚不同,tNGS 技术将“PCR”和“NGS”的优势结合,较 mNGS 极大提高了检测敏感性,tNGS 病原体设定范围明确,可排除宿主核酸干扰,且可以同时兼顾 DNA 和 RNA 流程,极大缩短了检测时间,具有高性价比、可定制化的特点,是一个可应用于多场景的技术平台。
今年 3 月,《高通量测序技术在分枝杆菌病诊断中的应用专家共识》正式发表,这也是首个 tNGS 相关的专家共识。

《共识》内容涵盖技术概况、技术特点、临床适应征和送检时机、标本采集、临床结果判读等五大方面,重点提到了分枝杆菌靶向测序应用于结核/NTM 病以及耐药的诊断优势,为在分枝杆菌病诊断过程中合理使用高通量测序技术提供参考。
mNGS vs tNGS,替补or互补?
tNGS 的突飞猛进,蚕食的正是 mNGS 的市场。但其实,与其说 tNGS 取代了 mNGS 的临床应用空间,不如说两种检测方法互补,共同提高了临床病原诊断的效率。
tNGS 和 mNGS 各有优势和局限性,它们在不同的场景下有着不同的适用性。
mNGS 的优势是能够对样本中所有的病原体进行无偏倚检测,发现新型或罕见病原体,同时可提供病原体的全基因组信息,利于病原的溯源、分型和耐药评估等;但局限性是需要较大的测序数据量和分析工作量,检测成本和时间较高,对低丰度的病原体检测灵敏度较低。

撒网式捕鱼
tNGS 的优势是能够对低丰度的病原体进行高灵敏度的检测,同时降低测序数据量和分析工作量,提高检测效率和成本效益;但局限性是只能检测预先设计好的病原体,无法发现新型或罕见的病原体,也无法对病原体进行全基因组分析。

多重鱼杆靶向钓鱼
因此,tNGS 和 mNGS 并不是相互替代的关系,而是相互补充和协同的关系。在临床微生物学领域,tNGS 更适合于常见或已知病原体的快速筛查和诊断,而 mNGS 更适合于未知或罕见病原体的探索和鉴定。两种技术结合使用,可以实现更全面、更准确、更高效的病原体检测。
此外,tNGS 从检测流程和周期上来看,整体 TAT 时间会略有缩短,但是在文库构建和高通量测序环节依旧需要花费很多的时间,但样本送到实验室内基本可以在 24-48 小时出结果。
各种病原检测方法怎么选?
在临床上,传统微生物学病原培养和经验判断仍是诊断的主流,但诊断的效率并不高。
细菌培养通常需要较长时间,要先预设,阳性率较低,很多时候还没等到培养结果出来就已经开始用药,分子生物学检测技术在一定程度上改善了这一现状。
PCR 是一种用于放大扩增特定 DNA 片段的分子生物学检测技术,一次可检测一种或几种病原;而面对多病原混合感染或未知感染时,PCR 难以满足临床的需求,而 tNGS 和 mNGS 可以解决这一方面的需求。
培养、PCR、tNGS、mNGS 等多种检测方法的合理选用,可覆盖临床感染性疾病检测的“轻、中、危”需求,为临床感染诊治提供病原学方面的指导。
(1)轻度感染(如普通流感)
建议常规检测手段,如培养、镜检、qPCR/RT-qPCR 等便可迅速锁定病原,对症下药,可满足大部分常规门急诊患者需求。
(2)常规中、危重感染
如常见肺炎链球菌、鲍曼不动杆菌(细菌),念珠菌属(真菌)、轮状病毒(病毒)等或混合感染时,建议采用靶向 tNGS 检测,灵敏度高、耗时短、性价比高,可满足常规门诊和住院患者需求。
(3)急危重症患者、不明原因感染(如 19 年的“新冠病毒”)和反复治疗效果不佳类患者
强烈建议进行 mNGS 检测,实现“宏”筛选,精准锁定病原,给急危重症和疑难患者带来新的希望。

目前,每种检测技术都有其在临床应用不可替代的优势,同时也有暂时无法解决的问题。或许未来很长一段时间内,培养、PCR、tNGS 和 mNGS 等检测方法会长期并存,为患者提供全方位、高性价比的检测体验。
美格医学助力临床精准诊断:
(1)Magiseq 病原微生物宏基因检测Magiseq 项目检测范围基于能提供广域搜索、并持续更新的参考基因组数据库,包含约有 60万+ 株微生物参考基因组,检测展示的结果主要来源于经过细致整理、可精确鉴定的微生物种类数据库,总共 23796 种。

图:Magiseq 检测范围
(2)TEPseq 病原微生物靶向基因检测TEPseq 是 Magiseq 技术的补充,解决了 Magiseq 受人源基因组及背景菌基因组干扰的问题;解决了 Magiseq 对结核、真菌、胞内菌等检出率低的问题;解决了 Magiseq 检测技术对 RNA 病毒检测难度大的问题;解决了 Magiseq 对耐药基因及毒力因子基因检测难点的问题。

图:TEPseq 检测范围
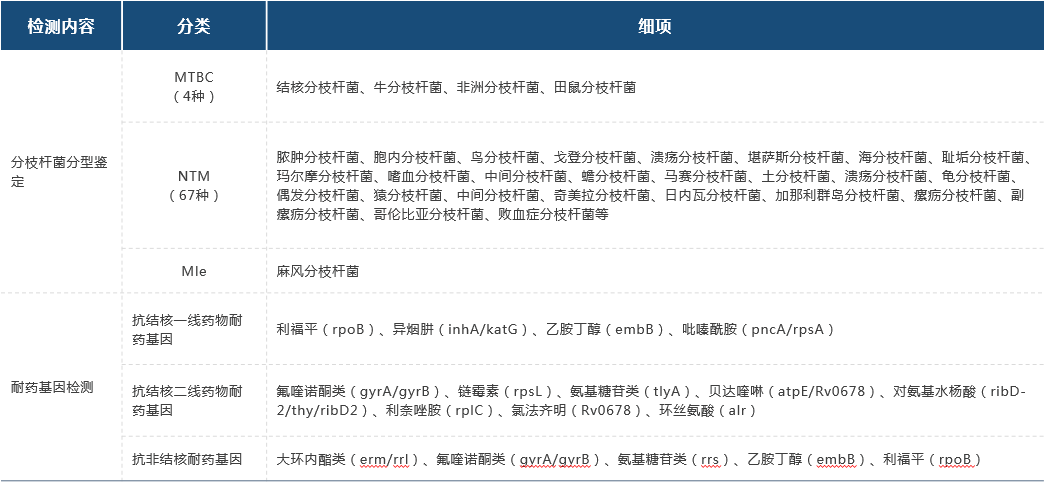
(3)TEMseq 分枝杆菌检测项目TEMseq 解决了 mNGS 分枝杆菌检出率较低的问题,可精确检测到大部分致病的结核分枝杆菌复合群,非结核分枝杆菌和麻风分枝杆菌等三类分枝杆菌及其耐药基因及毒力因子基因,助力临床精准抗感染。